Cada año mueren en España unas 30.000 personas por muerte súbita, gran parte de ellas causadas por una miocardiopatía hipertrófica, una enfermedad relativamente frecuente que provoca un engrosamiento del ventrículo izquierdo del corazón y que, en algunos casos, es hereditaria.
Hasta ahora, se habían descrito once genes responsables de esta cardiopatía pero que sólo explicaban la mitad de los casos; la otra mitad de los pacientes no presentaba mutaciones en ninguno de estos genes, de modo que no se sabía cuál era el gen responsable de su dolencia.
Ahora, un estudio basado en la secuenciación del genoma de pacientes españoles con miocardiopatía hipertrófica ha permitido identificar un nuevo gen mutado que explica parte de estos casos de miocardiopatía hipertrófica familiar.
La investigación, realizada por científicos españoles y publicada hoy en Nature Communications, ha sido dirigida por los doctores Carlos López-Otín, catedrático de Bioquímica y Biología Molecular de la Universidad de Oviedo, y Xose S. Puente, del Instituto de Oncología de la Universidad de Oviedo.
“Esta dramática realidad nos impulsó a estudiar el genoma de familias con casos de muerte súbita, utilizando las nuevas técnicas de análisis genómico desarrolladas en nuestro laboratorio como parte del proyecto de desciframiento de los genomas del cáncer”, explica López-Otín, codirector de la contribución española al Consorcio Internacional de los Genomas del Cáncer.
“El estudio genómico nos ha permitido concluir que mutaciones en el gen FLNC, codificante de una proteína denominada filamina C, causan miocardiopatía hipertrófica en 8 de las familias estudiadas”, señala el doctor Xose S. Puente.
En declaraciones a Efe, Ana Gutiérrez-Fernández, coautora del estudio, comenta que el nuevo gen identificado “permite explicar la causa de la enfermedad en un grupo de pacientes sin mutaciones en los genes conocidos”.
“Las nuevas técnicas de secuenciación de genomas nos están permitiendo identificar mutaciones en genes que hasta ahora desconocíamos”, explica Rafael Valdés-Mas, coautor del trabajo.
De hecho, agrega el investigador, “es muy probable que haya más genes implicados en esta enfermedad y que seguramente iremos identificando gracias a estas técnicas”.
El hallazgo permitirá identificar a las personas portadoras de esta mutación en el gen FLNC, hacer un “seguimiento clínico más personalizado” y aplicar un tratamiento específico e, incluso, si es necesario, se les podrá implantar un desfibrilador que evite el proceso que desencadena la muerte súbita en estos pacientes, destaca la investigadora.
El estudio cuenta con la participación de los grupos de doctores Eliecer Coto, José Julián R. Reguero y Aurora Astudillo, del Hospital Universitario Central de Asturias.
El trabajo en las Instituciones participantes en este proyecto está financiado por el Ministerio de Economía y Competitividad, el Instituto de Salud Carlos III, la Obra Social Cajastur, la Fundación Botín y la Fundación Asturcor.
.
.
La investigación partió del caso de una mujer de 53 años que llevaba más de 30 viviendo con la enfermedad (gracias, entre otras terapias, a que le implantaron un desfibrilador semiautomático en el corazón) y en cuya familia se habían dado varios casos de muerte súbita. El análisis de su ADN demostró que en su genoma no había ninguna de las mutaciones que previamente se habían relacionado con la miocardiopatía hipertrófica, por lo que era una candidata perfecta para la identificación de nuevas variantes.
La secuenciación del exoma (las partes codificantes del genoma) permitió a los investigadores asturianos dar con una mutación ‘sospechosa’ en FLNC, un gen que codifica una proteína denominada filamina C e implicada en la diferenciación de los miocitos y la función muscular, por lo que analizaron a nueve miembros de su familia para corroborar su papel. El análisis demostró la existencia de una relación directa con la miocardiopatía hipertrófica.
Los investigadores avanzaron un paso más y estudiaron a fondo dicho gen en otras 92 personas con la cardiopatía -y que tampoco presentaban las variantes genéticas conocidas relacionadas con la enfermedad- tratando de dilucidar el papel de FLNC. Ese estudio «permitió encontrar un total de ocho familias portadoras de distintas mutaciones en FLNC, todas ellas asociadas al desarrollo de la enfermedad», explican los investigadores.
Aunque todavía es difícil de estimar, las nuevas mutaciones identificadas «pueden llegar a representar el 10% de los casos de esta cardiopatía no causados por genes conocidos hasta el momento», añaden.
Previamente, ya se había relacionado a FLNC con otros trastornos del miocardio, por lo que en la revista científica los investigadores especulan que las mutaciones en este gen «pueden generar un espectro de trastornos del músculo» que provocan distintas anormalidades, con mayor o menor impacto en la vida del paciente.
Tras descubrir estas mutaciones, el equipo realizó un análisis funcional de dichas mutaciones para definir el mecanismo molecular por el que las mutaciones encontradas provocan la miocardiopatía, lo que ha permitido demostrar que las alteraciones genéticas causan la formación de agregados proteicos en el músculo cardíaco que se acumulan impidiendo el correcto funcionamiento del corazón.
En las conclusiones de su trabajo, los investigadores reconocen que el tamaño relativamente pequeño de la muestra analizada constituye una limitación, por lo que reclaman más estudios al respecto que ratifiquen sus hallazgos y definan el rol preciso que cumple FLNC en la miocardiopatía hipertrófica.
De momento, los científicos asturianos ya están «ampliando el estudio con más pacientes, secuenciando el genoma en un mayor número de familias para identificar a los posibles portadores de mutaciones en FLNC y tratar de descubrir nuevos genes implicados en esta patología».
enlazado a:
BIOLOGÍA MOLECULAR – artículos
CARLOS LÓPEZ-OTÍN
.
.
.
[los anuncios que se vean a partir de estas líneas serán una penalización que me impone el sistema por no pagar para que se me retiren]





La obra es «Cien años de felicidad»
El bioquímico López Otín desgranó en Muros sus fórmulas para «intervenir sobre los procesos genéticos del envejecimiento»
Muros de Nalón, Marcos PALICIO
Hace dos años casi exactos, otro viernes por la tarde, el auditorio de la Casa de Cultura de Muros de Nalón tenía el mismo aspecto que ayer, sin un sitio libre en las 150 butacas de la sala y en los pasillos, de pie, casi tantos espectadores como sentados. Carlos López Otín dudó, llegó a plantearse rechazar aquella invitación para volver a dar la misma charla en el mismo escenario; vacilaba por no repetirse, por si tenía pocas noticias nuevas que dar. Pero pensándolo bien, confesó casi al final, el problema era que «igual no me daba tiempo a contar todo lo que ha pasado en dos años» dentro y fuera una «fábrica de sueños diurnos» que está en el edificio Severo Ochoa de la Universidad de Oviedo y es un laboratorio de biología molecular.
Desde aquel 29 de julio de 2011, el equipo del catedrático oscense ha progresado en la lectura de los códigos que explican en clave molecular la vida, la enfermedad, el envejecimiento y la muerte. «Tratando de conocer para tal vez curar», acababa de presentar entonces «el primer paisaje genético de la leucemia linfática crónica»; guiados por la necesidad de «estudiar cada vida por separado», han llegado desde entonces a trescientos genomas secuenciados, a definir «las claves moleculares del envejecimiento» y a enseñar a leer en la estructura genética por qué «suma de procesos, daños o alteraciones» en el mapa genético su tía Joaquina, «hermana de mi abuela», ha llegado a cumplir 102 años. Ella salió por segunda vez ayer en las diapositivas de una charla de su sobrino-nieto -la primera fue hace un mes en Villaviciosa- justo antes de que el bioquímico explicase que en estos dos años en su laboratorio van aprendiendo a «explicar las maneras de intervenir sobre cada uno de esos procesos genéticos del envejecimiento para tratar de extender la longevidad».
En estos dos años, el último Nobel de Medicina, el japonés ShinyaYamanaka, también ha conseguido lo que a Otín, hace dos años, le parecía imposible: hacer retroceder las células en el tiempo, «hasta su estado embrionario». Es una marcha atrás de laboratorio que no llega aún a los extremos del cine de ciencia-ficción, que todavía no es «El curioso caso de Benjamin Button», la película en la que el personaje de Brad Pitt nacía con noventa años e iba rejuveneciendo y que ayer visitó la charla para ilustrar la certeza de que «farmacológicamente todavía no hemos avanzado sobre estos procesos. Afortunadamente».
En estos dos años, esto sí, en Oviedo «hemos reprogramado las células de Néstor y Guillermo para devolverlas atrás en el tiempo». Y Néstor y Guillermo son esos dos pacientes de envejecimiento prematuro, diagnosticados erróneamente de síndrome de Hutchinson-Gilford a los que el equipo de Otín descubrió el origen de la mutación del gen que causaba en realidad su deterioro físico, para los que diseñaron una estrategia terapéutica que ahora trata «a todos los niños del mundo que tienen su enfermedad», que ahora se llama «Síndrome de Néstor-Guillermo».
Lo suyo con las claves del envejecimiento es la versión de una lucha contra el tiempo que el científico prefiere llamar esfuerzo por «evitar la muerte a destiempo». Es ahí donde cabe su disección de las «arrugas nucleares», las de las células, las arrugas realmente importantes porque de verdad dan explicaciones sobre el envejecimiento. Ahí encaja también el estudio del genoma de una ballena boreal «que vive más de 250 años», o de la almeja Ming, «que se llama así porque cuando nació, hace 450 o 500 años, reinaba en China la dinastía Ming». O los de la hidra vulgar y algunos tipos de medusas, «organismos que tienen el mismo genoma que nosotros» y una particularidad nada vulgar, son inmortales.
En estos dos años, se ha construido vida químicamente -«escribiendo el código, no leyéndolo»- y en Oviedo se han descubierto «las causas de la muerte súbita en siete familias asturianas». Ha pasado y sigue pasando. Hasta ayer mismo por la mañana, cuando López Otín explicó a un paciente que habían descubierto «la causa de su enfermedad después de treinta años» y la fórmula por la que «un solo cambio entre los 3.000 millones de piezas químicas de su genoma le había provocado una enfermedad devastadora».
Cuando estuvo por última vez hablando en Muros, López Otín no tenía todavía su posesión material más preciada, que llegó por correo a su laboratorio después de una gira de conferencias por México. Es, según confesión del bioquímico oscense, una primera página de «Cien años de soledad» autografiada por Gabriel García Márquez donde está tachada la palabra soledad para que se lea, de puño y letra del autor, «cien años de felicidad para Carlos». Y el científico, que «podría pasar horas hablando de todo en lo que he fracasado», concluyó diciendo que el reto, resumiendo mucho, es «extender la calidad de vida hasta tiempos que antes habrían sido una hazaña». Eso equivale a aquello de «evitar la muerte a destiempo», incluso a mejorar el ejemplo del paciente de ayer por la mañana, que le dijo «llevo más de veinte años esperando a morirme porque me decían que no duraría más de cuatro o cinco».
El bioquímico también tuvo tiempo de rechazar con tres ejemplos de infelicidad mitológica y literaria la supuesta deseabilidad de lo inmortal, y a enfrentarse, en el turno de preguntas, al espinoso asunto de si el milagro de la vida incita a pensar en un «diseñador inteligente». Carlos López Otín confesó haber tenido fe y haberla perdido «a su debido tiempo» y cuestionó la pericia del arquitecto refiriéndose al ojo de los pulpos, diseñado como más perfecto y «eficaz» que el humano. Una de dos, dejó en el aire, «o el diseñador era poco inteligente o prefería los pulpos a los humanos».
Me gustaMe gusta
La cardiomiopatía hipertrófica (CMH) es una enfermedad hereditaria que afecta directamente al músculo cardíaco. Debido a varios casos muy publicitados de jóvenes atletas que murieron repentinamente de CMH, se la conoce más comúnmente como una enfermedad de los atletas. Pero esta enfermedad puede afectar a cualquiera —hombres, mujeres y niños de todas las edades— cualquiera sea su nivel de acondicionamiento físico.
La CMH es el segundo entre los tipos más comunes de cardiomiopatía. Cuando uno padece de CMH significa que las paredes del corazón son más gruesas de lo normal. Es normal que se produzca cierto aumento en el grosor de las paredes del corazón en personas sanas que hacen ejercicio o participan en deportes competitivos. Pero en la CMH ese engrosamiento es extremo.
Con el tiempo, el engrosamiento del músculo cardíaco puede hacer que el corazón se agrande o dilate. Esto se denomina «cardiomegalia». Los médicos típicamente pueden determinar la presencia de cardiomegalia midiendo el tamaño del corazón. Se considera cardiomegalia cuando el diámetro del corazón es de más de un 50 % del diámetro interno de la caja torácica (el índice cardiotorácico).
En la mayoría de los pacientes con CMH, el tabique que separa el lado izquierdo del corazón del lado derecho, sobresale hacia la cavidad inferior izquierda del corazón (el ventrículo izquierdo). A menudo se agrandan los músculos en ambas cavidades inferiores. Estas paredes musculares engrosadas pueden obstruir parcialmente el flujo de sangre por la válvula aórtica o impedir que el corazón repose entre latidos y se llene de sangre. En un pequeño número de enfermos con CMH, la válvula mitral, que separa la cavidad superior izquierda (aurícula izquierda) de la cavidad inferior izquierda (ventrículo izquierdo), también podría estar dañada. O la válvula mitral podría adherirse al tabique, obstruyéndose así el flujo de sangre por la válvula.
¿Cuáles son los síntomas?
Desmayarse durante una sesión de ejercicio intenso es a menudo el primer síntoma, y el más dramático, de esta enfermedad. Otros síntomas son la falta de aliento, el cansancio y el dolor en el pecho. Es imprescindible consultar inmediatamente al médico si se observan estos síntomas de advertencia.
Los adultos jóvenes atléticos que mueren de CMH generalmente mueren sin saber que sufrían de esta enfermedad. La CMH es también más difícil de diagnosticar en atletas por ser similar a un fenómeno inofensivo denominado «hipertrofia ventricular izquierda», en el que el ventrículo izquierdo del corazón se agranda debido al acondicionamiento físico. Toda persona, sea joven o vieja, que desee participar en una competición atlética muy activa debe primero consultar al médico y realizarse un examen físico completo que incluya un electrocardiograma (ECG) y una radiografía de tórax.
¿Cuáles son las causas de la CMH?
Los investigadores creen que este tipo de cardiomiopatía se transmite de generación en generación. En más de la mitad de los casos, la gente afectada tiene parientes cercanos que también tienen tabiques agrandados.
Afortunadamente, existe un estudio que puede determinar quién corre riesgo de sufrir CMH. Utilizando los resultados de este estudio, los médicos pueden prevenir a los niños que presentan factores de riesgo del peligro de realizar ejercicio demasiado intenso y de participar en ciertos deportes competitivos.
La presión arterial elevada y las enfermedades valvulares cardíacas también han sido identificadas como causas de la CMH.
¿Cómo se diagnostica la CMH?
¿Cómo se trata la CMH?
A menudo el tratamiento de esta enfermedad consiste en aliviar los síntomas en lugar de tratar la enfermedad en sí. Los principales tratamientos son la modificación del estilo de vida, los medicamentos y el tratamiento quirúrgico.
Modificación del estilo de vida
Los pacientes con CMH grave deben reducir el nivel de actividad física. Los niños y adultos jóvenes que se han realizado los estudios genéticos y presentan factores de riesgo de CMH deben evitar hacer demasiado ejercicio y participar en ciertos tipos de competiciones atléticas.
Medicamentos
Para aquellos pacientes que tienen síntomas leves o moderados, los medicamentos son, a menudo, el tratamiento recomendado.
Los medicamentos no son eficaces en todos los casos, especialmente en pacientes con síntomas más graves. Además, pueden tener efectos secundarios, tales como la acumulación de líquido en los pulmones o una presión arterial baja. En algunos casos, ciertos medicamentos podrían ocasionar la muerte súbita del paciente.
Tratamiento quirúrgico
Los médicos podrían recomendar tratamiento quirúrgico a los pacientes con CMH que tienen un daño cardíaco grave.
Tratamiento experimental no quirúrgico
La ablación con alcohol es un tratamiento no quirúrgico que consiste en inyectar alcohol en una pequeña rama de una arteria del corazón y en el tejido muscular cardíaco sobrante. El alcohol destruye el tejido muscular sobrante sin necesidad de extirparlo quirúrgicamente. La ablación con alcohol es un procedimiento relativamente nuevo que se realiza sólo en unos pocos centros de los Estados Unidos. El procedimiento se considera aún experimental
*TEXAS HEART INSTITUTE
Me gustaMe gusta
Hasta ahora, los médicos conocían 11 genes defectuosos que causan el 60% de los casos hereditarios de esta enfermedad. Pero cuando analizaban a Manuela no encontraban nada irregular en ninguno de ellos. Hoy, tras tres años de trabajo, un equipo de médicos y científicos de Asturias publica un estudio en el que desvelan una nueva causa genética de la miocardiopatía hipertrófica. Se debe a una mutación en un solo gen que ha pasado de generación en generación en la familia y se ha podido descubrir gracias a que Manuela sigue viva y se prestó a participar en el estudio. Gracias a ella los investigadores han confirmado que la mutación en cuestión causa los daños cardíacos característicos de esta enfermedad y han encontrado otras ocho familias en las que se dan casos similares relacionados con el mismo gen.
“Es seguro que este caso va a ayudar a salvar vidas”, explica Carlos López-Otín, investigador de la Universidad de Oviedo y uno de los autores del estudio. “Desde hoy ya ayuda a ocho familias cuyo destino dejará de ser fatal, porque vamos a saber quiénes portan la mutación y quienes no, lo que permitirá hacer un correcto seguimiento a los que la tienen y a los que no, les podremos decir que no tienen un riesgo mayor que cualquier otra persona”, detalla. Además, este caso clínico permitirá identificar nuevos casos familiares y ayudar a sus portadores a tomar importantes decisiones a la hora de tener hijos, por ejemplo, sabiendo que tienen un 50% de posibilidades de transmitir la mutación a sus descendientes. También será posible seguir de cerca, desde jóvenes, a los portadores y evitar casos repentinos de muerte súbita como el de la madre de Manuela.
La muerte súbita es el impacto “más llamativo” de la miocardiopatía hipertrófica, pero no el único, señala José Julián Reguero, el cardiólogo del Hospital Universitario Central de Asturias que llevaba 12 años tratando a Manuela. En otros casos la progresiva deformación de las paredes del corazón provoca fatiga, insuficiencia cardiaca, presión en el pecho, etc. Según Reguero, los nuevos marcadores genéticos hallados gracias a esta paciente se empezarán a aplicar de forma “automática” a otros pacientes con esta miocardiopatía. “Con las nuevas técnicas de secuenciación genómica podemos analizar muy rápidamente cinco o 10 genes y detectar de forma rutinaria la nueva mutación”, señala el coautor del estudio, que se publica hoy en Nature Communications.
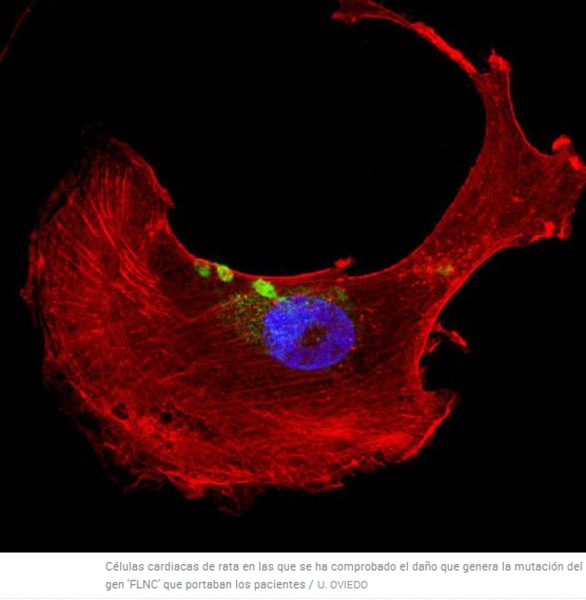
López-Otín se topó con el caso de Manuela en 2011. Su equipo había liderado la secuenciación del genoma de la leucemia linfática crónica, el cáncer sanguíneo más común. La tecnología que se desarrolló para ello permitía aplicar el potencial de secuenciación —leer los 3.000 millones de letras que contiene nuestro genoma— a enfermedades menos comunes. El equipo destapó así causas desconocidas de varias dolencias e incluso describieron otras nuevas, como el síndrome de Néstor-Guillermo, una nueva forma de envejecimiento prematuro hereditario. En este nuevo caso, descubrieron que Manuela presentaba una mutación en el gen FLNC. El equipo analizó otros 92 pacientes con la misma enfermedad y comprobó que otras ocho familias llevaban mutaciones en el mismo gen. Además, en su trabajo han demostrado en ratas que esas mutaciones provocan una acumulación de proteínas en el tejido del corazón que causa a su vez la miocardiopatía hipertrófica.
Ayudar a más familias
Expertos ajenos al trabajo resaltan la valía científica del estudio y también su potencial para aconsejar a los pacientes. “Es un trabajo muy bien hecho”, opina Nicasio Pérez Castellano, cardiólogo del Hospital Clínico de Madrid y secretario de la Sección de Electrofisiología y Arritmias de la Sociedad Española de Cardiología. “Además de identificar la mutación, el equipo ha demostrado en ratones que esta es la que causa la desestructuración del miocardio, el desorden celular y el engrosamiento del tejido el corazón”, detalla.
El estudio “permitirá identificar la causa genética de esta enfermedad en más familias”, resalta Pablo García Pavía, investigador el Centro Nacional de Investigaciones Cardiovasculares y jefe de la Unidad de Cardiopatías Familiares del Hospital Puerta de Hierro (Madrid). “Conocer la causa genética de la enfermedad no solo permite determinar a qué familiares hay que hacerles un seguimiento periódico y a cuáles no, también permite tomar decisiones importantes como, por ejemplo, si prefiero adoptar un niño a tenerlo y arriesgarme a pasarle la mutación, o si elegir una profesión a la que en el futuro no podré dedicarme si sufro del corazón”, resalta.
Sobrevivir al destino
El trabajo está directamente relacionado con la genética médica, una disciplina encargada de usar el creciente potencial de secuenciación en beneficio de los pacientes. Se trata de un área no exenta de polémica por las intromisiones de compañías privadas que ofrecen tests genéticos de dudosa validez y que pueden acabar desinformando a los pacientes. En este caso, el protocolo a seguir está claro, dice el cardiólogo Pérez Castellano. “Primero hay que diagnosticar la enfermedad y después analizar los genes causantes más comunes”, destaca. “De todos los genes identificados hasta el momento hay dos que son responsables del 80% de los casos”, explica Reguero. “El resto, incluido el recién descubierto, se reparten el otro 20% en proporciones similares y, por tanto, pequeñas”, añade. Por eso este tipo de trabajos es útil en casos muy concretos, en una minoría de pacientes, pero su impacto para su salud es muy importante. Es algo parecido a lo que sucedió con Néstor y Guillermo, dos chavales con progeria, o envejecimiento prematuro, cuyo genoma fue analizado por el equipo de López-Otín. Así se descubrió que tenían una mutación desconocida que causaba una nueva forma de la enfermedad, muy rara y más benigna, pues no afectaba al corazón, y permitió a Néstor y Guillermo superar los 20 y 30 años, respectivamente, cuando los pacientes normales suelen fallecer a los 15. En palabras de López-Otín, ejemplos como estos “ejemplifican el triunfo de la vida sobre un destino que parecía inexorable”.
NUÑO DOMINGUEZ
Me gustaMe gusta
El científico Carlos López Otín denuncia la falta de financiación para investigar
Ana Sánchez Borroy Zaragoza 03/11/2014 – 09:14 CET
Este científico altoaragonés recuerda que algunos proyectos no pueden depender de decisiones políticas cambiantes y, por ello, se emplea a fondo en buscar financiación como sea, a través de fundaciones españolas o incluso financiación internacional. López Otín habla, por ejemplo, del proyecto que investiga los genomas del cáncer.
López Otín ha vuelto a las portadas de los medios de comunicación en los últimos días por identificar un nuevo gen responsable de las alteraciones cardíacas y de la muerte súbita, que provoca cada año la muerte de 30.000 personas. Es una enfermedad que muchos asocian únicamente a deportistas de élite pero que tiene, a la vista de los datos, mayor trascendencia de la que le damos.
Apunta que tiene un factor hereditario y por ello una de las cosas que más le ha sorprendido es su desconocimiento en la sociedad: por ejemplo, le llama la atención que algunos familiares de fallecidos por muerte súbita ni siquiera saben que puede analizarse si han heredado el gen que les predispone a sufrir esta enfermedad.
Me gustaMe gusta